研究内容

私達が目指していること
現在、日本人の2人に1人ががんに罹患し、4人に1人はがんで死亡するとされています。高齢化社会の到来によりがん罹患・死亡率は、今後、さらに増加することが予想されます。従って、がんをより深く理解し、疾患の早期発見とより有効な治療法の開発に結びつけることは、我々が健康な社会生活を送る上で大変重要です。近年の急速な医学の進歩によりがんの治療成績は目に見えて向上していますが、早期発見が困難ながん、治療抵抗性のがん、再発・転移性のがんにどう対処するかなど、解決すべき課題は山積しています。
がん化は遺伝子の異常・多様性と環境要因との動的な相互作用により引き起こされると考えられます。近年、次世代シーケンサーをはじめとするテクノロジーの進歩により、がんに対する我々の理解は飛躍的に進みました。しかしながら、正常細胞、がん前駆細胞、がん細胞ががん化の過程で直面する様々な選択圧力に対してどの様に反応し、進むべき道筋を選択し、その過程が進行していくのかは十分に解明されていません。がん細胞は、がん化の非常に早期から、代謝をはじめとする細胞機能制御遺伝子の発現プログラムを書き換えることで、生育環境に適応し、免疫監視機構から逃れ、生存と増殖の継続を確かなものとしていると考えられています。我々は、特に、環境応答とエピジェネティクス制御に重点を置いて研究をしています。
エピジェネティクスとは、DNA塩基配列の変化を伴わない遺伝子発現の変化を意味します。そういった情報はヒストンなどのDNA結合タンパク質の修飾、核酸修飾、非翻訳RNAの発現などにより制御されます。エピジェネティクスによる遺伝子発現制御が、前がん病変の段階から発育進展にいたるまで、がん細胞の生物学的特性の獲得に寄与していることが近年明らかとなってきています。従って、革新的ながん予防と治療法を開発するためには、内的・外的環境シグナルに対する細胞応答を制御する分子機序の詳細を、個体レベルで明らかにする必要があると考えます。我々は、ゲノム編集・改変等の技術を用いて作成したモデルマウス、培養細胞、オルガノイドを用い、エピゲノム解析、細胞生物学的・生化学的アプローチ、イメージング技術等を用いて解析しています。また、がん予防の見地から、老化・肥満の制御にも興味を持ち、研究分野を広げています。
これまでの研究概要
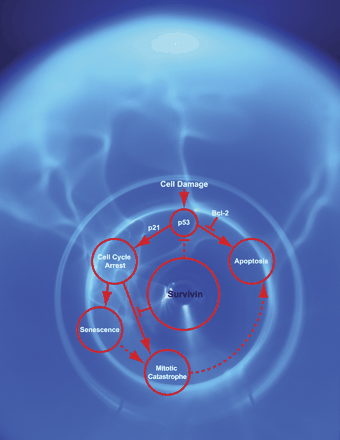
1. 細胞死制御
細胞の環境応答の表現系の一つである細胞死に着目しています。細胞死の機能異常はがん細胞の特質の一つとされており、実際、細胞死制御因子の機能異常とがん化には密接な関連があることが多数報告されています。具体的には、TP53信号伝達経路に重点を置き、細胞死制御に関わる遺伝子群に焦点を当てその分子機序を研究しています。
Generation and characterization of Smac/Diablo-deficient mice. Okada H, Suh WK, Jin J, Woo M, Du C, Elia A, Duncan GS, Wakeham A, Itie A, Lowe SW, Wang X, Mak TW. Mol Cell Biol. 22:3509-3517 (2002)
Survivin loss in thymocytes triggers p53-mediated growth arrest and p53-independent cell death. Okada H*, Bakal C, Shahinian A, Elia A, Wakeham A, Suh WK, Duncan GS, Ciofani M, Rottapel R, Zuniga-Pflucker JC, Mak TW. J Exp Med. 199:399-410 (2004) (*Corresponding author)
Pathways of apoptotic and non-apoptotic death in tumour cells. Okada H, Mak TW. Nat Rev Cancer 4(8): 592-603 (2004)
Bat3 deficiency accelerates the degradation of Hsp70-2/Hspa2 during spermatogenesis. Sasaki T, Marcon E, McQuire T, Arai Y, Moens PB, Okada H. J Cell Biol.182:449-458 (2008)
J Exp Med. Vol. 199, 3. Cover art by Graham Hutcheson
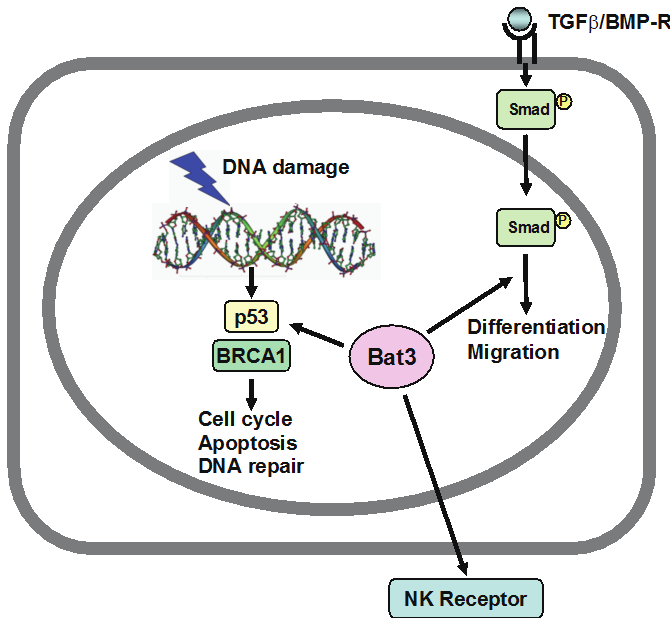
2. DNA損傷応答
外的環境シグナルの一つとしてDNA損傷に着目しています。
DNA損傷とその修復機構の異常はがん細胞におけるゲノムの不安定を引き起こし、がん化を誘導するとともに、がん細胞の不均一化を生み出す重要な要因となり、がんの悪性度、治療抵抗性獲得に寄与すると考えられます。
我々はDNA損傷応答、特にdouble strand break (DSB)に対する細胞応答を制御するメカニズムを研究しています。
HLA-B-associated transcript 3 (Bat3)/Scythe is essential for p300-mediated acetylation of p53. Sasaki T, Gan EC, Wakeham A, Kornbluth S, Mak TW, Okada H. Genes Dev. 21:848-861 (2007)
Attenuated DNA damage repair delays therapy-related myeloid neoplasms in a mouse model. Tong KI, Ota K, Komuro A, Ueda T, Ito A, Koch AC, Okada H. Cell death & Disease Oct 6;7(10):e2401 (2016 )
Ascorbate sensitizes human osteosarcoma cells to the cytostatic effects of cisplatin. Oka N, Komuro A, Amano H, Dash S, Honda M, Ota K, Nishimura S, Ueda T, Akagi M, Okada H. Pharmacology Research & Perspectives (2020 Aug 8; 8(4)e00632)
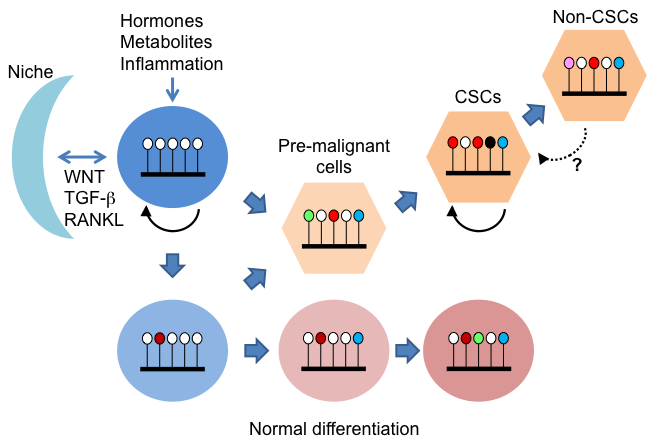
3. 代謝とエピジェネティクス
がん化の過程には遺伝子変異とともに、主として環境要因によって形成されるエピジェネティクスを介する短期的、長期的遺伝子発現制御が重要な役割を果たすと考えられます。
しかしながら個体におけるその機能の詳細は十分明らかにされていません。我々はヒストンメチル化修飾を制御するメカニズムに着目し、がん化の過程および代謝制御への影響を研究しています。
Histone demethylase Jmjd2b functions as a co-factor of estrogen receptor in breast cancer proliferation and mammary gland development. Kawazu M, Saso K, Tong KI, McQuire T, Goto K, Son D-O, Wakeham A, Miyagishi M, Mak TW, Okada H. PLoS ONE 6:e17830 (2011)
The H3K27 demethylase, Utx, regulates adipogenesis in a differentiation stage-dependent manner. Ota K, Tong KI, Goto K, Tomida S, Komuro A, Wang Z, Nishio K, Okada H. PLOS ONE 12(3): e0173713 (2017)
JMJD2B/KDM4B inactivation in adipose tissues accelerates obesity and systemic metabolic abnormalities. Kang C, Saso K, Ota K, Kawazu M, Ueda T, Okada H. Genes Cells (online 2 August, 2018)
High Fat Diet Triggers a Reduction in Body Fat Mass in Female Mice Deficient for Utx demethylase. Ota K, Komuro A, Amano H, Kanai A, Ge K, Ueda T, Okada H. Scientific Reports (11 July, 2019)
KDM4B promotes acute myeloid leukemia associated with AML-ETO by regulating chromatin accessibility. Ueda T*, Kanai A, Komuro A, Amano H, Ota K, Honda M, Kawazu M, Okada H.* (*co-correspondence) FASEB BioAdvances 29 August 2021.
MYC/glutamine dependency is a therapeutic vulnerability in pancreatic cancer with deoxycytidine kinase inactivation-induced gemcitabine resistance. Dash S, Ueda T, Komuro A, Amano H, Honda M, Kawazu M, Okada H. Mol Cancer Res (2023) 21 (5): 444–457 (online publication Feb 9, 2023)
Deoxycytidine Kinase Inactivation Enhances Gemcitabine Resistance and Sensitizes Mitochondrial Metabolism Interference in Pancreatic Cancer. Dash S, Ueda T, Komuro A, Honda M, Sugisawa R, Okada H. Cell Death & Disease (2024) 15:131
Vgll2 as an integrative regulator of mitochondrial function and contractility specific to skeletal muscle. Honda M, Inoue R, Nishiyama K, Ueda T, Komuro A, Amano H, Sugisawa R, Dash S, Shirakawa J, Okada H. J Cell Physiol. (2024) e31436 109940; DOI:10.1002/jcp.31436